- Химический справочник Плотность растворов хлорида натрия при 20° С
- Теплофизические свойства и температура замерзания водных растворов NaCl и CaCl2
- Теплофизические свойства раствора CaCl2 (кальций хлористый)
- Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
- Теплопроводность раствора CaCl2 в зависимости от температуры
- Теплоемкость раствора CaCl2 при 0°С
- Температура замерзания растворов солей NaCl и CaCl2
- Плотность раствора NaCl в зависимости от температуры
- Теплопроводность раствора NaCl в зависимости от температуры
- Удельная теплоемкость раствора NaCl при 0°С
- Теплофизические свойства раствора NaCl
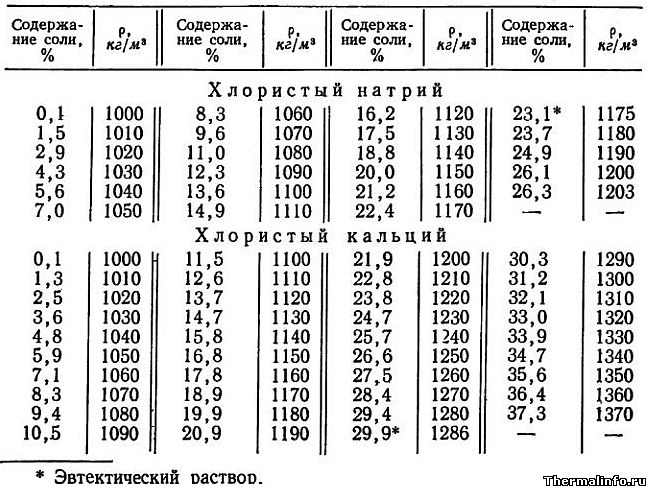
- Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
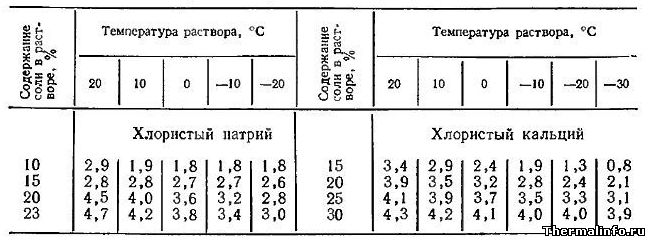
- Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
- Хлорид натрия
- Содержание
- Нахождение в природе и производство
- Галит
- Каменная соль
- Морская соль
- Залежи
- Производство
- Применение
- В пищевой промышленности и кулинарии
- В медицине
- В коммунальном хозяйстве. Техническая соль
- Регенерация Nа-катионитовых фильтров
- Химическая промышленность
- Получение хлора и гидроксида натрия
- Получение металлического натрия
- Получение соляной кислоты и сульфата натрия
- Физические и физико-химические свойства
- Лабораторное получение и химические свойства
- Структура
Химический справочник
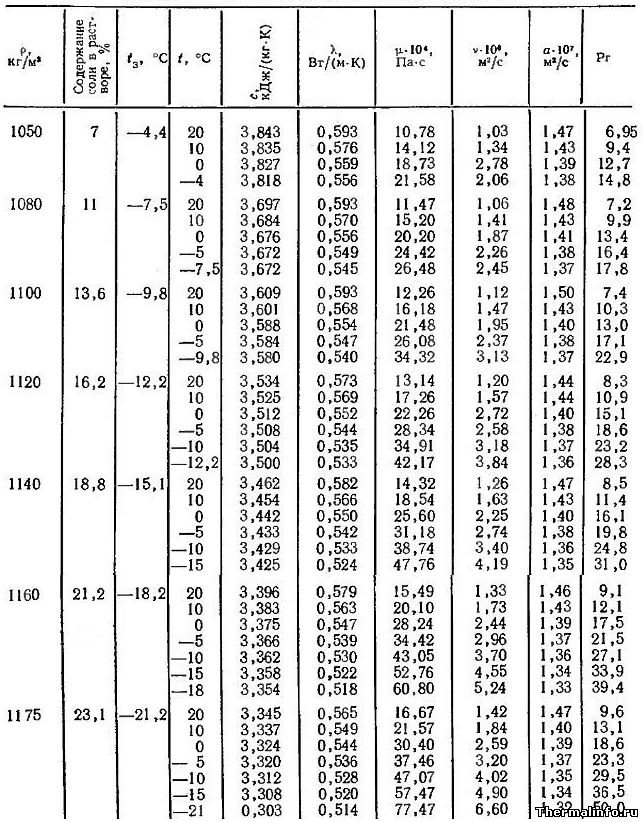
Плотность растворов хлорида натрия при 20° С
Плотность растворов хлорида натрия при 20° С
| Содержание NaCl | Плотность, г/мл | |
| % | г/л | |
| 1 | 10,05 | 1,0053 |
| 2 | 20,25 | 1,0125 |
| 4 | 41,07 | 1,0268 |
| 6 | 62,48 | 1,0413 |
| 8 | 84,47 | 1,0559 |
| 10 | 107,1 | 1,0707 |
| 12 | 130,3 | 1,0857 |
| 14 | 154,1 | 1,1009 |
| 16 | 178,6 | 1,1162 |
| 18 | 203,7 | 1,1319 |
| 20 | 229,6 | 1,1478 |
| 22 | 256,1 | 1,1640 |
| 24 | 283,3 | 1,1804 |
| 26 | 311,3 | 1,1972 |
| Плотность растворов соли отнесена к плотности воды при 4° С. | ||
× Источник: Иванов В.М., Семененко К.А., Прохорова Г.В., Симонов Е.Ф. Аналитическая химия натрия. -М.: Наука, 1986. C. 245.
Теплофизические свойства и температура замерзания водных растворов NaCl и CaCl2
Теплофизические свойства раствора CaCl2 (кальций хлористый)
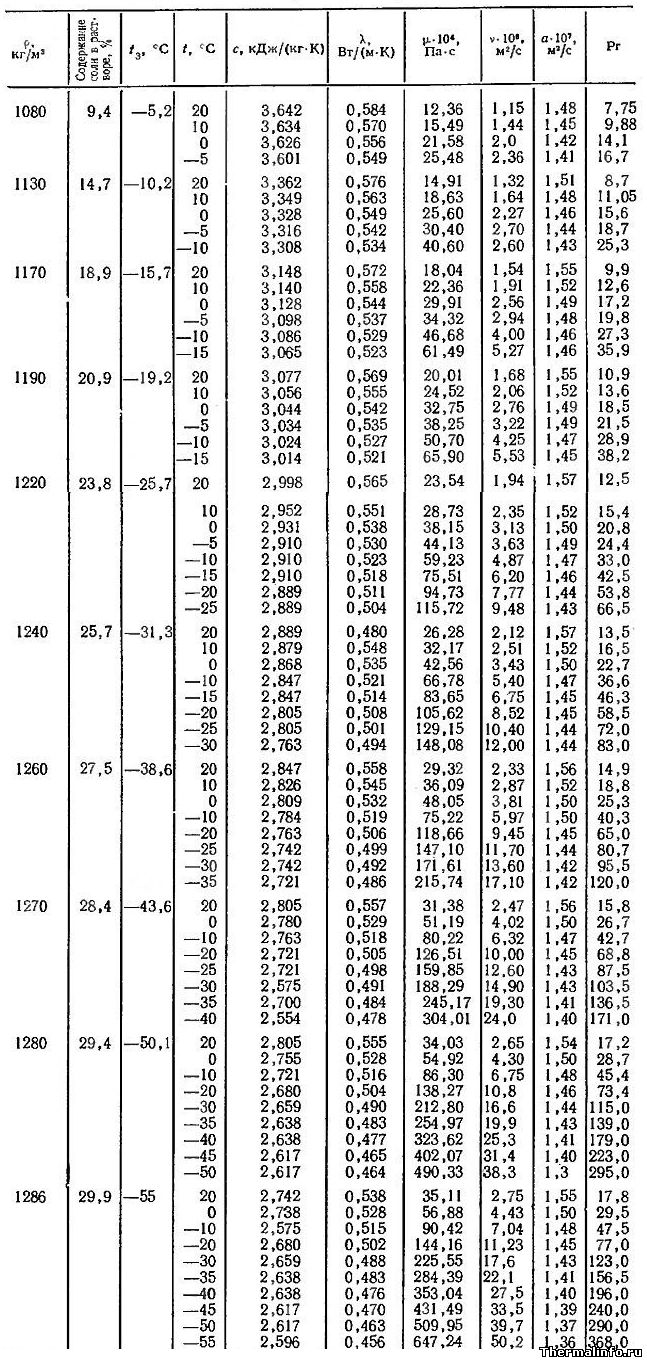
В таблице представлены теплофизические свойства раствора хлористого кальция CaCl2 в зависимости от температуры и концентрации соли: удельная теплоемкость раствора, теплопроводность, вязкость водных растворов, их температуропроводность и число Прандтля. Концентрация соли CaCl2 в растворе от 9,4 до 29,9 %. Температура, при которой приведены свойства определяется содержанием соли в растворе и находится в диапазоне от -55 до 20°С.
Водный раствор хлорида кальция CaCl2 может не замерзать до температуры минус 55°С. Для достижения этого эффекта концентрация соли в растворе должна быть 29,9%, а его плотность составит величину 1286 кг/м 3 .
При увеличении концентрации соли в растворе увеличивается не только его плотность, но и такие теплофизические свойства, как динамическая и кинематическая вязкость водных растворов, а также число Прандтля. Например, динамическая вязкость раствора CaCl2 с концентрацией соли 9,4 % при температуре 20°С равна 0,001236 Па·с, а при увеличении концентрации хлорида кальция в растворе до 30% его динамическая вязкость увеличивается до значения 0,003511 Па·с.
Следует отметить, что на вязкость водных растворов этой соли наиболее сильное влияние оказывает температура. При охлаждении раствора хлорида кальция с 20 до -55°С его динамическая вязкость может увеличиться в 18 раз, а кинематическая — в 25 раз.
Даны следующие теплофизические свойства раствора CaCl2:
- плотность раствора, кг/м 3 ;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость водных растворов, Па·с;
- кинематическая вязкость раствора, м 2 /с;
- коэффициент температуропроводности, м 2 /с;
- число Прандтля.
Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
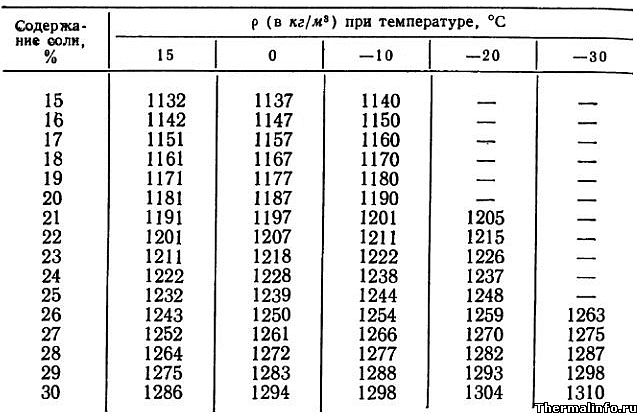
В таблице указаны значения плотности раствора хлористого кальция CaCl2 различной концентрации в зависимости от температуры.
Концентрация хлорида кальция CaCl2 в растворе от 15 до 30 % при температуре от -30 до 15°С. Плотность водного раствора хлористого кальция увеличивается при снижении температуры раствора и увеличением в нем концентрации соли.
Теплопроводность раствора CaCl2 в зависимости от температуры
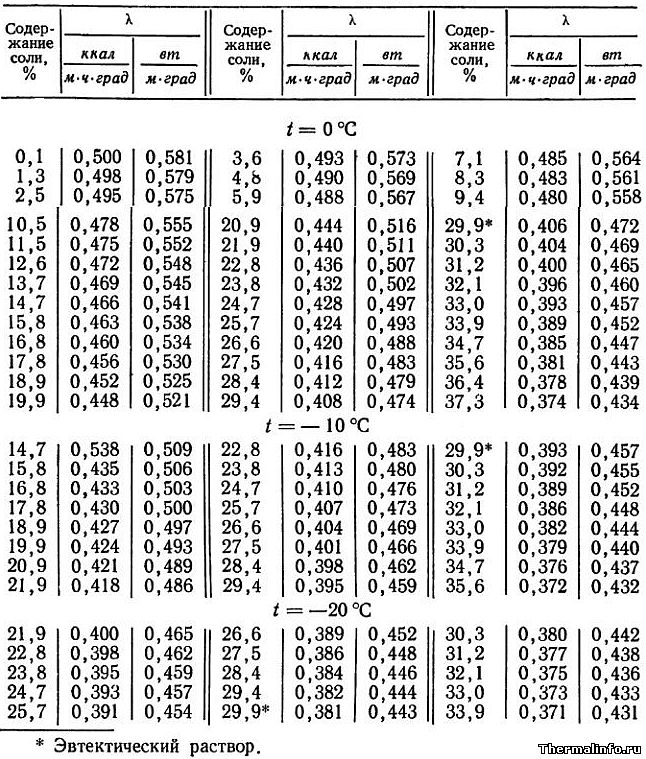
В таблице представлены значения теплопроводности раствора хлористого кальция CaCl2 различной концентрации при отрицательных температурах.
Концентрация соли CaCl2 в растворе от 0,1 до 37,3 % при температуре от -20 до 0°С. По мере роста концентрации соли в растворе его теплопроводность снижается.
Теплоемкость раствора CaCl2 при 0°С
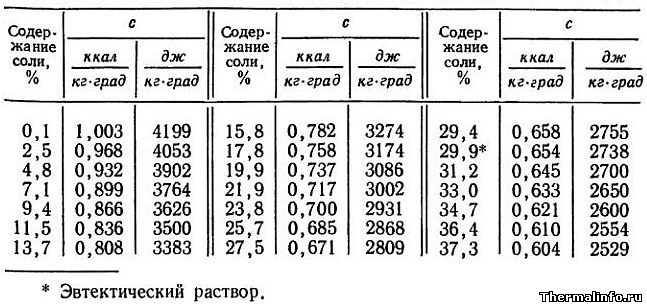
В таблице представлены значения массовой теплоемкости раствора хлористого кальция CaCl2 различной концентрации при 0°С. Концентрация соли CaCl2 в растворе от 0,1 до 37,3 %. Следует отметить, что с повышением концентрации соли в растворе, его теплоемкость снижается.
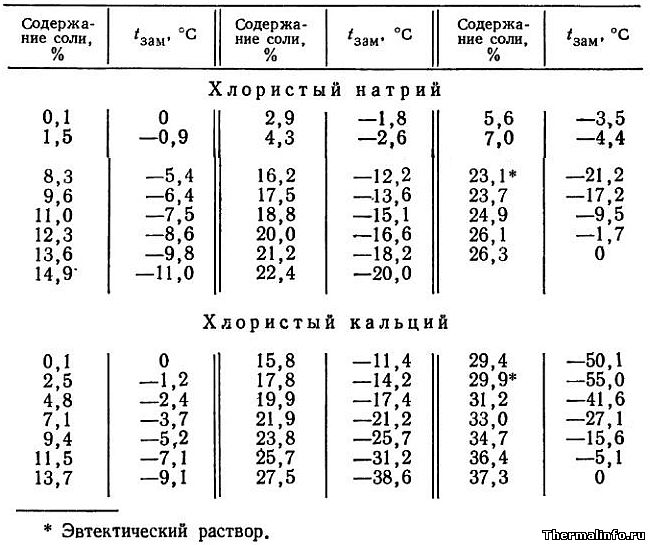
Температура замерзания растворов солей NaCl и CaCl2
В таблице приведена температура замерзания растворов солей хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации соли. Концентрация соли в растворе от 0,1 до 37,3 %. Температура замерзания солевого раствора определяется концентрацией соли в растворе и для хлорида натрия NaCl может достигать значения минус 21,2°С для эвтектического раствора.
Необходимо отметить, что раствор хлористого натрия может не замерзать до температуры минус 21,2°С, а раствор хлористого кальция не замерзает при температуре до минус 55°С.
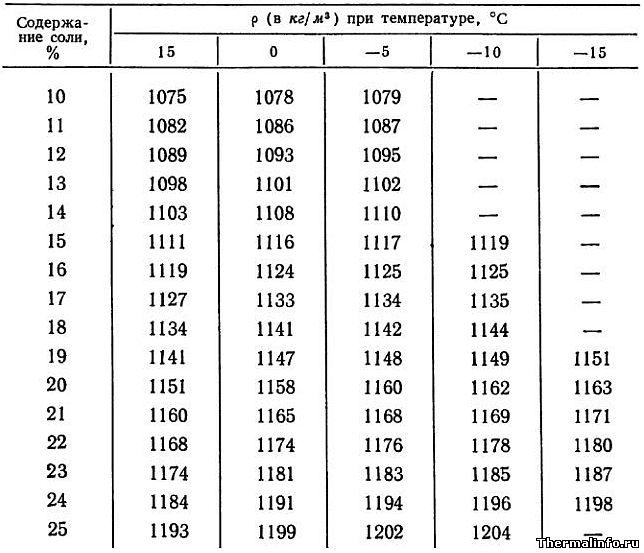
Плотность раствора NaCl в зависимости от температуры
В таблице представлены значения плотности раствора хлористого натрия NaCl различной концентрации в зависимости от температуры.
Концентрация соли NaCl в растворе от 10 до 25 %. Значения плотности раствора указаны при температуре от -15 до 15°С.
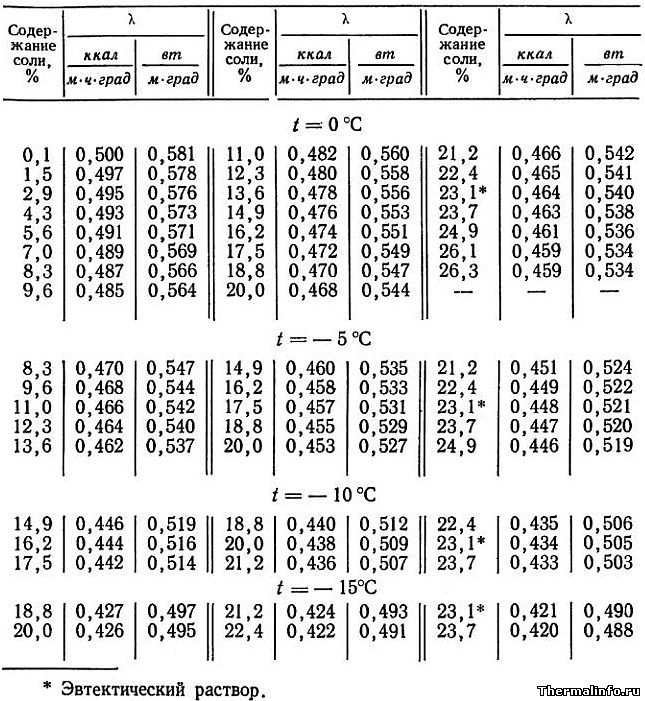
Теплопроводность раствора NaCl в зависимости от температуры
В таблице даны значения теплопроводности раствора хлористого натрия NaCl различной концентрации при отрицательных температурах.
Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре от -15 до 0°С. По данным таблицы видно, что теплопроводность водного раствора хлорида натрия снижается по мере роста концентрации соли в растворе.
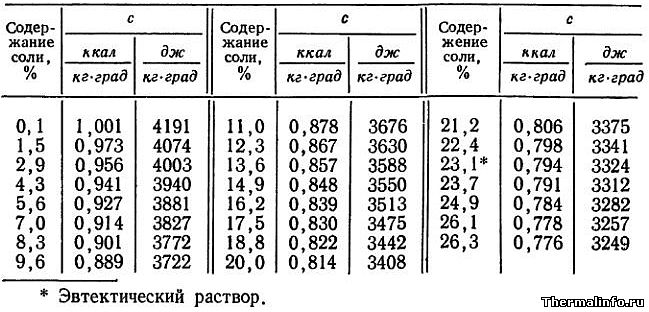
Удельная теплоемкость раствора NaCl при 0°С
В таблице представлены значения массовой удельной теплоемкости водного раствора хлористого натрия NaCl различной концентрации при 0°С. Концентрация соли NaCl в растворе от 0,1 до 26,3 %. По данным таблицы видно, что с повышением концентрации соли в растворе, его теплоемкость снижается.
Теплофизические свойства раствора NaCl
В таблице представлены теплофизические свойства раствора хлористого натрия NaCl в зависимости от температуры и концентрации соли. Концентрация хлорида натрия NaCl в растворе от 7 до 23,1 %. Необходимо отметить, что при охлаждении водного раствора хлорида натрия его удельная теплоемкость меняется слабо, теплопроводность снижается, а значение вязкости раствора увеличивается.
Даны следующие теплофизические свойства раствора NaCl:
- плотность раствора, кг/м 3 ;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость раствора, Па·с;
- кинематическая вязкость раствора, м 2 /с;
- коэффициент температуропроводности, м 2 /с;
- число Прандтля.
Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
В таблице представлены значения плотности растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации. Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре раствора 15°С. Концентрация хлорида кальция CaCl2 в растворе находится в диапазоне от 0,1 до 37,3 % при его температуре 15°С. Плотность растворов хлорида натрия и кальция растет при увеличении содержания в нем соли.
Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
В таблице даны значения среднего коэффициента объемного расширения водных растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации и температуры.
Коэффициент объемного расширения раствора соли NaCl указан при температуре от -20 до 20°С.
Коэффициент объемного расширения раствора хлорида CaCl2 представлен при температуре от -30 до 20°С.
- Чубик И. А., Маслов А. М. Справочник по теплофизическим характеристикам пищевых продуктов и полуфабрикатов.
- Данилова Г. Н. и др. Сборник задач по процессам теплообмена в пищевой и холодильной промышленности. М.: Пищевая промышленность, 1976.- 240 с.
Хлорид натрия
| Хлорид натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Традиционные названия | обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | NaCl | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса | 58,44277 г/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность | 2,165 г/см³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Термические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 800,8 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 1465 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость (ст. усл.) | 50,8 Дж/(моль·К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплота испарения | 170,85 кДж/моль Дж/кг | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплота плавления | 28,68 кДж/моль Дж/кг | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 6,7–7,3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость в воде | 35,6 (0 °C) 35,9 (25 °C) 39,1 (100 °C) г/100 мл | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость в метаноле | 14,9 г/100 мл | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость в аммиаке | 21,5 г/100 мл | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оптические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Показатель преломления | 1,5442 (589 нм) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая, cF8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рег. номер CAS | [7647-14-5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рег. номер PubChem | 5234 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рег. номер EINECS | 231-598-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | [Na+].[Cl-] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RTECS | VZ4725000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Безопасность | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЛД50 | 3000–8000 мг/кг | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
При испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая [5] .
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах [4] . Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы [6] :
 | …на мори от чрена и от салгы по пузу… |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн) [8] .
Добыча соли в южной части Мертвого моря, Израиль
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием [9] .
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
CaR2 + 2NаСl = 2NаR + CaСl2. МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности [10] . Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков [11] . Суммарное уравнение реакции электролиза горячего раствора хлорида натрия [12] :
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах [13] [14] :
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H + , образованных в результате электролитической диссоциации воды: H2O ⇆ H + + OH − 2 H + + 2 e − → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа: NaCl → Na + + Cl − 2 Cl − − 2 e − → Cl2↑
- суммарная реакция: 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре [15] .
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO [14] :
2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия [14] [16] :
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий: 2 Na + + 2 e − → 2 Na
- на аноде выделяется хлор (как побочный продукт): 2 Cl − − 2 e − → Cl2
- суммарная реакция: 2 Na + + 2 Cl − → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия [17] .
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4 [18] [19] .
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 + , Mg 2 + и SO 2− 4 ), и такая соль на воздухе сыреет [20] . Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C [21] .
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH 0 g | −181,42 кДж/моль |
| ΔfH 0 l | −385,92 кДж/моль |
| ΔfH 0 s | −411,12 кДж/моль |
| ΔfH 0 aq | −407 кДж/моль |
| S 0 g, 1 bar | 229,79 Дж/(моль·K) |
| S 0 l, 1 bar | 95,06 Дж/(моль·K) |
| S 0 s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией [22] :
Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой [23] :
NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na + + Cl − , его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
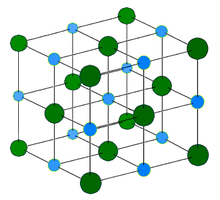
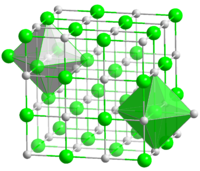
Структура
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl − окружен шестью ионами Na + в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na + , то останется плотно упакованная кубическая структура с ионов Cl − , называемая гранецентрированной кубической решеткой. Ионы Na + тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
Adblockdetector