- Плотность пропана
- Плотность пропана и другие его физические свойства
- Химический состав, строение молекулы и плотность пропана
- Примеры решения задач
- Химия, Биология, подготовка к ГИА и ЕГЭ
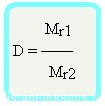
- Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
- Еще на эту тему:
- Обсуждение: «Относительная плотность по… задачи»
- Простейшие расчетные задачи в органической химии.
Плотность пропана
Плотность пропана и другие его физические свойства
С воздухом пропан образует взрывоопасные смеси, в случае если концентрация его паров находится в пределах 1,7 – 10,9%. При температуре 466 o С и давлении 0,1 МПа (760 мм. рт. ст.) пропан самовоспламеняется на воздухе. Он легко сжижается и в виде смеси с другими газообразными алканами, например с бутаном, используется в быту как топливо (баллонный газ). Кроме этого, пропан применяется как автомобильное топливо.
Основные константы пропана приведены в таблице ниже.
Таблица 1. Физические свойства и плотность пропана.
0,5005 (жидкость) [t = 20 o C, Р = 4 атм]
Температура плавления, o С
Химический состав, строение молекулы и плотность пропана
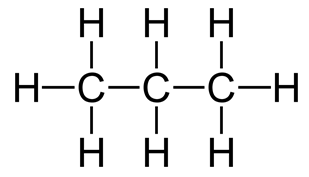
Химический состав молекулы пропана можно отобразить эмпирической (C3H8) и рациональной (CH3-CH2-CH3) формулами (рис. 1).
Рис. 1. Строение молекулы пропана.
В молекуле пропана гибридизации подвергаются одна s-орбиталь и три p-орбитали от каждого атома углерода. Вид и число орбиталей, участвующих в гибридизации определяет её тип. В пространстве эти орбитали расположены относительно друг друга под одинаковыми углами и направлены к вершинам тетраэдра.Тип гибридизации атомов углерода в молекуле пропана, как и в других алканах – sp 3 .
Примеры решения задач
| Задание | Плотность паров простого вещества азота по водороду – 14. Определите формулу азота. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа. |
Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа:
Тогда, молярная масса газа азота будет равна:
Относительная атомная масса азота равна 14,0067 а.е.м. Тогда, в состав молекулы азота входит Mgas /Ar(P) атомов азота:
Значит формула молекулы азота N2.
| Задание | Плотность газа по воздуху – 0,59. Массовая доля элемента азота в нем – 82,35%, а водорода – 17,65%. Выведите формулу газа. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Обозначим число атомов азота в молекуле через «х», число атомов водорода через «у».
Найдем соответствующие относительные атомные массы элементов азота и водорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
Значит простейшая формула соединения азота и водорода имеет вид NH3.
Значение молярной массы газа можно определить при помощи его плотности по воздуху:
Mgas = 29 × 0,59 = 17,11 г/моль.
Чтобы найти истинную формулу соединения азота и водорода найдем отношение полученных молярных масс:
M(NH3) = Ar(N) + 3 × Ar(H) = 14 + 3 × 1 = 14 + 3 = 17 г/моль.
Таким образом формула вещества будет иметь вид NH3. Это аммиак.
Химия, Биология, подготовка к ГИА и ЕГЭ
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
- Если дана относительная плотность паров по водороду, то Mr (вещества)=Mr(H2)•D=2 г\моль • D;
- если дана относительная плотность по воздуху, то Mr (вещества)=Mr(воздуха)•D=29 г\моль • D (обратите внимание, Mr(воздуха) принята равной 29 г\моль);
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 г\моль • D
Mr(вещества)=29 г\моль • 1.448 = 42 г\моль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 г\моль · 0.8571=36 г\моль
x=Mr(Cx)\Ar(C)=36 г\моль ÷ 12 г\моль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 г\моль · 0.1429=6 г\моль
x=Mr(Hy)\Ar(H)=6 г\моль ÷ 1 г\моль =6.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 г\моль ·1.05=42 г\моль
Запишем уравнение горения:
Найдем количество углекислого газа и воды:
Соотношение х : y\2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
Наше вещество — C3H6 — пропен
- pадание ЕГЭ по этой теме — задачи С5
Еще на эту тему:
Обсуждение: «Относительная плотность по… задачи»
Поясните, пожалуйста, как решать задачу : Укажите относительную плотность по кислороду паров дибромпроизводного алкана, молекула которого содержит 5 атомов углерода.
Спасибо.
Так. давайте по-порядку:
1) у нас дибромпроизводное алкана, содержащего 5 атомов С, т.е. его формула будет С5H10Br2
2) Mr( С5H10Br2 )= 230 г\моль
3) указать надо плотность паров по кислороду, т.е. нам нужна Mr (O2). Mr(O2)=32 г\моль
и, наконец,
4) D = Mr (( С5H10Br2 ) \ Mr(O2) = 230\32 = 7,1875
Спасибо, Лолита. Была у меня загвоздка с 4-м пунктом. Делила наоборот.
Спасибо Вам большое за помощь и прекрасные и доступные объяснения (уже не в первый раз 🙂 ).
Ой как приятно! И вам спасибо за добрый отзыв! Кстати, у вас осталось 2 тематических комментария — и вы получите подарочек от сайта! 🙂
Здравствуйте! Бьюсь над такой задачей. Если можете — помогите. Относительные плотности по неону паров высшего хлорида и бромида одного и того же элемента равны соответственно 8,5 и 17,4. Установите элемент. Буду признательна!
Добрый день! Все решается по формулам:
Mr(ЭxCly) = Mr(Ne) * D(Ne) = 8.5 * 20 г/моль = 170 г/моль;
M(ЭxBry) = Mr(Ne) * D(Ne) = = 17.4 * 20 г/моль = 348 г/моль;
Методом подбора по таблице Менделеева
Если хлора 1 атом, то Ar(Э) = 170-35.5 =134.5 г\моль
нет такого элемента
Если хлора 2 атома, то Ar(Э) = 170-71 =99г\моль
Возможно, это Те
Проверим по брому: Ar(Э) =348-160 = 188
не подходит
Значит, элемент трехвалентный — считаем, там тоже не подходит.
Остается валентность 4:
Ar(Эх) = 28 г\моль — получаем либо кремний: SiCl4 \SiBr4, либо галогеналкен: C2Cl4 \С2Br4
Оксид трехвалентного металла массой 12г восстановили смесью водородом с оксидом углерода. В результате реакции образовалось 5,4г воды и 413,2г диоксида углерода. Определите металл.
Э2О3 + 2H2 + CO = 2Э + 2H2O + CO2
n(H2O)=m\Mr = 0.3 моль
n(Э2О3) = 0.15 моль
Mr=m\n=12\0.15 = 80 г\моль
Ar(Me)=(80-48)\2 = 16 — такого металла нет
Пробуем по CO2:
n(CO2)=m\Mr=413.2\44 = 9.4 моль
n(оксида)=n(CO2)
Mr=m\n = … не получается
Проверьте условие задачи. Что-то там не то с числами…
Объясните пожалуйста, почему уравнение реакции CxHy+O2 = !xCO2 + !y/H2O
меня интересуют места, где х и у. Спасибо!
CxHy+O2 = xCO2 + y/2H2O
Что означает уравнение реакции? сколько атомов вступило в реакцию, столько же и образовалось, Значит, если в веществе х атомов С (Сх), то и CO2 будет х молекул.
Если водорода вступило y атомов, то образуется y\2 молекул воды.
Проще на примере:
допустим, сожгли этан:C2H6
вот уравнение:
С2Н6 + O2 = 2CO2 + 3H2O
Понятно?
Здравствуйте,помогите пожалуйста с задачей:при сжигании органического в-ва массой 8.6 г получили V(СО2)=13.44 дм3 и m(H2O)=12.6г.
Относительная плотность этого в-ва по кислороду равна 2.6875.
определите молекулярную формулу в-ва.
Добрый день!
составляем уравнение горения:
CxHyOz + O2 -> xCO2 + y\2H2O
по относительной плотности находим M( вещества) = 2.6875*32 г\моль =86 г\моль
n ( вещества ) = m\M = 8.6 u\86 г\моль = 0.1 моль
n(CO2) = V\Vм = 13.44 л\22.4 л\моль = 0.6 моль
n(H2O = m\M = 12.6 г \ 18 г\моль = 0.7 моль
получаем соотношения: 1: х как 0.1 к 0.6 => х=6
1: y\2 как 0.1 к 0.7 y=14
C6H14
Здравствуйте!стыдно признаться,но я как в школе не понимала химию,так я не понимаю ее и сейчас когда учится сын и помочь совсем не могу.Может Вы поможете: Вычислите относительную плотность по воздуху и водороду для газов: метан (CH4), углекислый газ (CO2). Спасибо Вам огромное заранее!
Относительная плотность вещества по воздуху = M(вещества) \ M(воздуха) (29 г\моль)
Относительная плотность вещества по водороду = M(вещества) \ M(H2)
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту равна 1,57. (Ответ: С3Н8.)
Здравствуйте! Помогите оформить , пожалуйста очень срочно нужно
M(вещества)=M(N2)*D=28г\моль*1.57
M(Cx)=M(вещества)*0.818
X=M(Cx)\12 г\моль
Количество водорода = М(вещества)-М(Сх)
Ответ вам уже дан 🙂
Здраствуйте,смотрите я не могу понять как это решить((
1.Укажите относительную плотность карбона(IV) оксида с азотом
2.Укажите малярную масу газов относительная густота какого за водородом равняеться 32
3.Укажите относительную густоту пропану за C3H3воздухом
4.Укажите формулу газа который тяжелее воздуха(надеюсь вы мне ответите по тому что я в химии полный ноль()
мнда….
Это учитель вам дал такие формулировки?
1) если вы имеете в виду плотность оксида углерода (IV)по азоту, то это M(CO2)\M(N2)/ Молярные массы веществ находите в периодической системе
2) если нужно найти молярную массу газа с плотностью по водороду 32, то M = 32*2 г\моль
3) плотность пропана по воздуху? Кстати, формула пропана — C3H8…. 44 г\моль \ 29 г\моль . Если все же вам дано вещество C3H3? то разделите его молярную массу на 29
4) CO2 например
W(H)=14,3%
Относительная плотность по водороду 21.
Найти формулу CхHy
Добрый день!
Тут все ровно по 2-м формулам:
M(CxHy)=21*2 г\моль = 42 г\моль
M(Hy)=42 г\моль* 0.143 = 6 г\моль
y = M(Hy)\Ar(H) = 6\6 = 1
значит, M(Cy)=42-6 = 36 г\моль
y = M(Cy)\Ar(C) = 36\12 = 3
C3H6
Помогите пожалуйста. Природный газ состоящий из этана, пропан, метана имеет относительную плотность по водороду 10.8. Рассчитайте массовую долю углерода в газе.
Помогите, пожалуйста, решить задачу:
Плотность смеси озона с кислородом по водороду равна 18. Найти, исходя из этого, объёмный состав смеси.
Средняя молярная масса смеси равна M(смеси) = M(H2)*D(H2) =18*2 = 36 г/моль
Пусть доля кислорода в ней будет Х, тогда доля озона будет 1 — Х
Тогда уравнение будет выглядеть так:
16Х = 12
Х = 0,75 ии 75 %
В смеси 75 % кислорода и 25 % озона
Относительные плотности по водороду оксидов элементов Х и Y равны, соответственно, 14 и 15. Определите формулы этих оксидов. Как решить, пожалуйста!
Добрый день!
M( оксида 1) = 14*2 г\моль = 28 г\моль, предположим, что в оксиде 1 атом О, тогда 12 г\моль — атомная масса элемента. Это С
M( оксида 2) = 15*2 г\моль = 30 г\моль. Если у нас 1 атома О, то 14 г\моль — приходится на элемент, но такого в Периодической системе нет. Предположим, то элемент одновалентный, т.е. оксид состоит из двух атомов элемента, по 7 г\моль — это Li
Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 4,9 пропустили над нагретым паладиевым катализатором. При этом образовалась газовая смесь с плотностью по водороду на 20% больше исходной газовой смеси. Определите объемные доли веществ в полученной газовой смеси
Простейшие расчетные задачи в органической химии.
Определите плотность метана по водороду. В поле ответа введите число. Ответ округлите до целых.
Определите плотность пропена по гелию. В поле ответа введите число. Ответ округлите до десятых.
Определите плотность пропина по фтороводороду. В поле ответа введите число. Ответ округлите до целых.
Определите плотность паров бензола по аргону. В поле ответа введите число. Ответ округлите до десятых.
Определите плотность паров 1,2-дибромэтана по кислороду. В поле ответа введите число. Ответ округлите до сотых.
Определите плотность паров этанола по воздуху. В поле ответа введите число. Ответ округлите до сотых.
Определите плотность диметилового эфира по угарному газу. В поле ответа введите число. Ответ округлите до сотых.
Определите плотность паров этаналя по водороду. В поле ответа введите число. Ответ округлите до целых.
Определите плотность паров метановой кислоты по воздуху. В поле ответа введите число. Ответ округлите до сотых.
Определите плотность паров диизопропиламина по гелию. В поле ответа введите число. Ответ округлите до сотых.
Плотность паров неизвестного соединения по воздуху равна 2. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по водороду равна 22. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по гелию равна 19,5. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по хлору равна 1,183. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по воздуху равна 1,517. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по водороду равна 29. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по гелию равна 16,125. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Плотность паров неизвестного соединения по азоту равна 2,107. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по аргону равна 1,8. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения по воздуху равна 2,897. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность неизвестного соединения при нормальных условиях равна 1,25 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность неизвестного соединения при нормальных условиях равна 1,875 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность неизвестного соединения при нормальных условиях равна 714 мг/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность неизвестного соединения при нормальных условиях равна 1,339 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Плотность паров неизвестного соединения при нормальных условиях равна 2,589 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовая доля углерода в неизвестном углеводороде равна 80%. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовая доля водорода в неизвестном углеводороде равна 16,67 %. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовая доля углерода в неизвестном углеводороде равна 90 %. Определите его молярную массу, считая простейшую формулу эмпирической. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовые доли углерода и азота в неизвестном амине равны 53,33 % и 31,11 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовые доли углерода и хлора в неизвестном галогеналкане равны 17,98 % и 79,78 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Массовые доли углерода и кислорода в неизвестном спирте равны 52,17 % и 34,78 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовые доли углерода и брома в неизвестном галогеналкане равны 12,63 % и 84,21 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовые доли углерода и азота в неизвестном мононитроалкане равны 40,45 % и 15,73 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовые доли углерода и кислорода в неизвестном кетоне равны 62,07 % и 27,59 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Массовая доля углерода в неизвестном углеводороде равна 82,76 %. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При сгорании органического вещества, не содержащего кислород, образовалось 22 г углекислого газа и 18 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При сгорании органического вещества, не содержащего кислород, образовалось 6,72 л углекислого газа и 7,2 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При сгорании органического вещества, не содержащего кислород, образовалось 11 г углекислого газа и 6,72 л паров воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При сгорании органического вещества, не содержащего кислород, образовалось 4,4 г углекислого газа и 2,057 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При сгорании органического вещества, не содержащего кислород, образовалось 22,4 л углекислого газа и 20 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При взаимодействии навески вещества состава С3Н6 массой 4,2 г с бромом образовалось 19,8 г продукта реакции состава C3H6Br2. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При взаимодействии навески вещества состава С4Н10 массой 2,9 г с хлором образовалось 4,0 г продукта реакции состава C4H9Сl. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
При взаимодействии навески вещества состава С3Н4 массой 8,0 г с водой образовалось 10,0 г продукта реакции состава C3H6О. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
При нагревании навески вещества состава С2Н2 массой 2,6 г с активированным углем образовалось 2,1 г продукта реакции состава C6H6. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
При окислении навески вещества состава С6Н10 массой 8,2 г водным раствором перманганата калия образовалось 10,6 г продукта реакции состава C6H12О2. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
При взаимодействии навески вещества состава С2Н6 массой 3,0 г с бромом образовался продукт реакции состава C2Н5Br с выходом 85%. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до сотых.
При взаимодействии навески вещества состава С4Н8 массой 5,6 г с хлороводороом образовался продукт реакции состава C4Н9Cl с выходом 80 %. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
При взаимодействии навески вещества состава С4Н8О массой 3,6 г с водородом образовался продукт реакции состава C4Н10О с выходом 96 %. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до сотых.
При взаимодействии навески вещества состава С2Н7N массой 9,0 г с азотистой кислотой образовался продукт реакции состава C2Н6О с выходом 75 %. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до сотых.
При взаимодействии навески вещества состава С3Н4О2 массой 3,6 г с бромом образовался продукт реакции состава C3Н4Br2О2 с выходом 95%. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до целых.