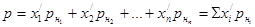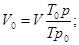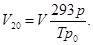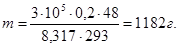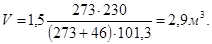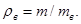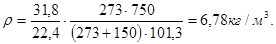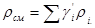- Плотность газа
- Плотность газа и другие его физические свойства
- Относительная плотность газа
- Глава 2. Расчет физико-химических свойств и состава углеводородных газов
- Как изменяется плотность воздуха в зависимости от давления: формулы, графики, таблицы
- Как плотность воздуха зависит от давления: формула
- Онлайн калькулятор плотности при разных давлениях
- Как меняется плотность воздуха в зависимости от давления
- Как меняется давление воздуха в системах вентиляции и кондиционирования
- Как напор вентилятора влияет на плотность воздуха
- Изменение атмосферного давления
Плотность газа
Плотность газа и другие его физические свойства
Одной из важнейших физических свойств газообразных веществ является значение их плотности.
Данную величину обычно обозначают греческой буквой r или латинскими D и d. Единицей измерения плотности в системе СИ принято считать кг/м 3 , а в СГС – г/см 3 . Плотность газа – справочная величина, её обычно измеряют при н. у.
Зачастую, применительно к газам используют понятие «относительная плотность». Данная величина представляет собой отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диокисда углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях – 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Относительная плотность газа
Обозначим относительную плотность газа m1 / m2 буквой D. Тогда
Следовательно, молярная масса газа равна его плотности по отношению у другому газа, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
или, если округлить молярную массу водорода до 2:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше равна 22, находим:
Плотность газа в лабораторных условиях самостоятельно можно определить следующим образом: необходимо взять стеклянную колбу с краном и взвесить её на аналитических весах. Первоначальный вес – вес колбы, из которой откачали весь воздух, конечный – вес колбы, наполненной до конкретного давления исследуемым газом. Разность полученных масс следует разделить на объем колбы. Вычисленное значение и есть плотность газа в данных условиях.
Чтобы рассчитать плотность газа при н.у. нужно воспользоваться уравнением состояния идеального газа:
В таблице ниже приведены значения плотностей некоторых газов.
Таблица 1. Плотность газов при нормальных условиях.
Глава 2. Расчет физико-химических свойств и состава углеводородных газов



Расчет физико-химических свойств и состава углеводородных газов
2.1 Особенности расчета физико-химических свойств газовых смесей. Плотность газов
Общие свойства газовых смесей. По сравнению с молекулами жидкости молекулы газов удалены друг от друга на неизмеримо большие расстояния, чем их собственные размеры. С этим связаны некоторые особые свойства газов, например способность к сжатию со значительным изменением объема, заметное повышение давления с ростом температуры и т.д. Поведение газообразных веществ достаточно полно объясняет кинетическая теория газов, основу которой составляют законы газового состояния Бойля-Мариотта, Гей-Люссака и Шарля [10]. Эти законы могут быть выражены объединенным уравнением (законом) Клайперона-Менделеева
Здесь R – универсальная газовая постоянная, значение которой зависит от выбора системы единиц. Так, в СИ, где давление выражено в паскалях, объем – в кубических метрах и температура – в кельвинах, для одного моля газа R=8,314 Дж/(моль×К).
Зависимость между парциальными давлениями pi компонентов газовой смеси и общим давлением p в системе устанавливается законом Дальтона
где 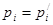
В соответствии с законом Рауля в условиях равновесия можно записать
или (см. уравнением 1.10) 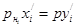
Приведенные выше законы полностью справедливы для идеальных газов. Углеводородные газы и нефтяные пары можно приближенно считать идеальными газами, особенно при невысоких давлениях. При расчетах допустимо использовать все названные законы. Об особых случаях расчета будет сказано ниже.
Напомним, что в приложении к газам существуют нормальные и стандартные условия, которые при одном и том же давлении (101,3 кПа) отличаются только температурой (273 К и 293 К, соответственно для нормальных и стандартных условий). Параметры, характеризующие состояние газа в нормальных условиях, имеют индекс 0 (V0, p0, T0), в стандартных – 20 (V20, p20, T20). Приведение объема газа к нормальным или стандартным условиям легко осуществляется по формулам:
Пример 2.1 В баллоне вместимостью 0,2 м 3 при давлении 3×10 5 Па и температуре 20°С находится газовая смесь, средняя молярная масса которой М=48 г/моль. Определить массу газовой смеси.
Решение. Зная, что число молей равно отношению массы вещества к его молярной массе, запишем уравнение Клапейрона-Менделеева в виде pV=(m/M)RT. Выразим массу газа m: m=pVM/RT. Подставив известные значения параметров, определим массу газа:
Пример 2.2 Газ при давлении 230 кПа и температуре 46°С занимает объем 1,5 м 3 . Привести объем газа к нормальным условиям.
Решение. Нормальный объем газа определим, имея в виду, что Т0=273 К и р0=101,3 кПа,
Плотность. Как и для жидкости, плотность газа может быть выражена абсолютным или относительным значением. Абсолютная плотность газа равна его массе в единице объема, в СИ она выражается в килограммах на кубический метр (кг/м 3 ). Величину, обратную плотности, называют удельным объемом и измеряют в кубических метрах на килограмм (м 3 /кг).
При определении относительной плотности газов и паров нефтепродуктов в качестве стандартного вещества берется воздух при нормальных условиях (Т=273 К, r=101,3 кПа). Отношение массы газа m к массе воздуха mв, взятых в одинаковых объемах и при тех же температуре и давлении, дает относительную плотность газа:
Масса любого идеального газа при нормальных условиях равна его молярной массе, поделенной на объем, занимаемый одним молем, т.е. 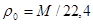
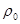
Тогда для относительной плотности газа по воздуху можно записать 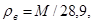
Если записать уравнение Клапейрона-Менделеева в виде m/V=pM/RТ, нетрудно увидеть, что левая часть представляет собой плотность газа r, т.е.
Формула (2.2) дает возможность подсчитать истинную плотность газа при любых температуре и давлении.
Существует другая модификация уравнения Клапейрона-Менделеева, также позволяющая определить плотность газа при любых условиях:
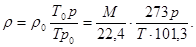
Результаты, получаемые по формулам (2.2) и (2.3), одинаковы. Плотность некоторых индивидуальных газов в зависимости от изменения температуры можно, кроме того, найти по графикам и таблицам [11].
Пример 2.3. Относительная плотность газа равна 1,10. Определить его абсолютную плотность при 150°С и 750 кПа.
Решение. Найдем молярную массу газа:
Абсолютную плотность газа определим по формуле (2.3):
Тот же ответ получим, воспользовавшись формулой (2.2), однако в этом случае нужно выразить М в килограммах на моль (умножить на 10 -3 ), чтобы привести в соответствие с единицами измерения универсальной газовой постоянной.
Плотность газовой смеси может быть подсчитана по формулам для жидкой смеси (см.§1.2). Учитывая, что для газов объемные доли равны молярным, в приложении к газовой смеси можно записать
Значения плотности и некоторых других свойств индивидуальных газов приведены в прил.16.
2.1. Определить вместимость баллона, в который можно закачать
6 м 3 газа, измеренного при нормальных условиях. Максимальное давление в баллоне 15 МПа.
2.2. Во сколько раз возрастет давление в герметичном газовом резервуаре, если температура окружающего воздуха повысится с 10 до 24°С?
2.3. При давлении 360 кПа и температуре 400 К газ занимает объем 1,2 м 3 . Найти число молей газа.
2.4. Газ в количестве 9 кг находится в сосуде вместимостью 3 м 3 при 298 К и 462 кПа. Найти молярную массу газа.
2.5. Определить объем газа при нормальных условиях, если при температуре 120°С и давлении 790 кПа его объем равен 16,3 м 3 .
2.6. Используя уравнение (2.1), найти плотность метана и этана при нормальных условиях.
2.7. Определить плотность пропана при 150 кПа и 80°С.
2.8. Средняя молярная масса водородсодержащего газа, применяемого в процессе каталитического риформинга, равна 3,5 г/моль. Рассчитать плотность этого газа при 450°С и 3 МПа.
2.9. Газовая смесь состоит из метана и водорода, парциальные давления которых равны 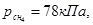
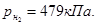
2.10. Рассчитать плотность газовой смеси, состоящей из 14 кг пропана, 11 кг этана и 8 кг этилена. Плотности индивидуальных газов взять в прил.16.
2.11. Смешали 3 моля пропана и 7 молей пропилена. Какова плотность полученной смеси?
2.12. Относительная плотность газовой смеси по воздуху равна 1,3. При какой температуре абсолютная плотность станет равной 7 кг/м 3 , если давление в системе составляет 640 кПа?
2.13. Природный газ Астраханского происхождения имеет следующий состав (в объемных процентах): СН4 – 47,48; С2Н6 – 1,92; С3Н8 – 0,93; С4Н10 – 0,56; С5Н12 –3,08; N2 –1,98; СО2 – 21,55; Н2S – 22,5. Определить плотность газа при нормальных условиях.
Как изменяется плотность воздуха в зависимости от давления: формулы, графики, таблицы
Чем выше давление, тем более сжатым является воздух, и тем выше его плотность. Этот же вывод следует из формулы плотности ρ = p · M / (R · T). Давление находится в числителе, и при его возрастании будет возрастать плотность.
Как плотность воздуха зависит от давления: формула
Формула плотности воздуха выводится из уравнения Менделеева-Клапейрона и выглядит следующим образом:
ρ = p · M / (R · T), где
- p – давление воздуха (в системах вентиляции и кондиционирования обычно принимается нормальное атмосферное давление 101 325 Па, но если объект находится в горах, необходимо учитывать изменение плотности в зависимости от высоты над уровнем моря. Об этом рассказано в отдельной статье).
- М – молярная масса воздуха (29 г/моль, более точное значение 28,98 г/моль),
- R – универсальная газовая постоянная (8,314 Дж/(моль·К)),
- Т – температура в Кельвинах
Плотность воздуха возрастает при увеличении давления
Плотность уменьшается при снижении давления
Онлайн калькулятор плотности при разных давлениях
Наш калькулятор позволяет рассчитать плотность воздуха в зависимости от температуры и давления. Полученный результат можно сохранить в виде ссылки и поделиться им с коллегами. Чтобы скопировать ссылку, нужно нажать на кнопку «Копировать».
| Хочу такой же калькулятор себе на сайт | |
| Исходные данные | |
|---|---|
| Температура воздуха: | |
| Давление воздуха: | |
| Результат расчета | |
| Плотность воздуха: | |
| Хочу такой же калькулятор себе на сайт | |
Ссылка на этот расчет: Копировать Как меняется плотность воздуха в зависимости от давленияИз формулы плотности воздуха вытекает, что чем выше давление, тем выше его плотность. И наоборот, чем ниже давление, тем ниже плотность воздуха. Зависимость прямо пропорциональная. Таким образом, если давление увеличится в 2 раза, то и плотность воздуха возрастет в 2 раза. Если давление снизить в 3 раза, то плотность воздуха снизится в 3 раза. Плотность воздуха при давлении 1 Па составляет 0.000012761 кг/м³. Как меняется давление воздуха в системах вентиляции и кондиционированияНапор вентилятора в небольших приточных системах, как правило, на 100-500 м³/ч, составляет порядка 300-400 Па. В системах средней производительности (до 5000 м³/ч) напор достигает 1000 Па. В мощных системах с расходом в десятки тысяч м³/ч может потребоваться напор до 2000-3000 Па. Как напор вентилятора влияет на плотность воздухаВ малых системах — почти никак, влияние минимально. В крупных системах разница может достигать 1-3%. Действительно, давайте обратимся к цифрам. Допустим, в крупной системе вентиляции давление воздуха изменяется на 3000 Па. Базой при этом является атмосферное давление, равное 101 325 Па. Таким образом, мощный вентилятор меняет давление примерно на 3%. Следовательно, после вентилятора плотность воздуха будет на 3% выше. Имейте ввиду: мощный вентилятор способен повысить плотность воздуха на 3% В меньших системах с напором в 300-600 Па влияние и того меньше: от 0,3% до 0,6%. Инженерная погрешность в расчетах составляет 5%, следовательно при расчете воздухообмена, систем вентиляции и кондиционирования учитывать изменение плотности смысла нет. А вот влияние высоты над уровнем моря и температуры учитывать надо обязательно. Также следует учитывать изменение атмосферного давления воздуха. Изменение атмосферного давленияОбратимся теперь к зависимости плотности воздуха от атмосферного давления, ведь цифра 101 325 не является постоянной всегда и везде. Даже в одном регионе и городе в зависимости от погоды давление может меняться в широком диапазоне: от 700 до 800 мм. рт. ст. Например, самое низкое атмосферное давление в Москве было зафиксировано 25 ноября 1973 года и составило 709 мм. рт. ст., а самое высокое – 14 декабря 1944 года — 782 мм. рт. ст. Это интересно: В России атмосферное давление менялось в диапазоне от 700 до 812 мм рт. ст. Плотность воздуха при этом менялась на 16%. В России давление изредка опускалось и ниже 700 мм. рт. ст., а максимальным считается давление, зафиксированное 31 декабря 1969 года в Сибири — 812 мм. рт. ст. Так как плотность воздуха прямо пропорциональна давлению, то она за это время менялась более чем на 16%. Однако это экстремумы. Вентиляцию нет смысла считать по параметрам, которые бывают раз в жизни. Лучше использовать средние данные для регионов страны: Adblockdetector | |